Caderno SBDOF
Caderno 9 - Sensibilização Central
Autores: Daniela Ap. de Godoi Gonçalves, Guilherme V. do Vale Braido, Juliana dos Santos Proença
1. O que é Sensibilização Central?A Sensibilização Central (SC) é um processo de hipersensibilidade caracterizado por redução dos limiares de excitação de neurônios centrais mediante diferentes estímulos, associado a uma função inadequada do Sistema Endógeno de Controle da Dor que atua modulando a dor1. Os fatores envolvidos com o desenvolvimento da SC ainda são bastante discutidos, embora evidências apontem para participação conjunta de aspectos neurofisiológicos e psicossociais. Além disso, evidências indicam que fatores genéticos podem ter papel importante nesse processo2.
Diversos mecanismos podem estar envolvidos com o desenvolvimento da SC. O influxo persistente de estímulos advindos da periferia, como músculos e articulações, pode sensibilizar os neurônios de segunda ordem localizados no SNC, reduzindo seus limiares de ativação. Nesse estado, os neurônios centrais tendem a responder de forma exacerbada a estímulos nocivos de baixa intensidade (hiperalgesia), bem como a estímulos não nocivos (alodínia)1,3. A expansão do campo receptivo dos neurônios também representa outro mecanismo importante. A excitação prolongada dos neurônios de segunda ordem ativa os neurônios adjacentes, expandindo seus campos receptivos, fazendo com que impulsos advindos de tecidos sem lesões também causem dor4.
Quando a SC está presente, não são apenas os sinais nociceptivos que podem ser erroneamente processados, mas também outros estímulos sensoriais como a luminosidade, estímulos sonoros, olfatórios e até mesmo químicos5. Ainda, como mencionado acima, a SC envolve uma função inadequada do sistema de modulação da dor6. Esse sistema atua promovendo analgesia endógena, modulando a intensidade dos impulsos dolorosos e controlando o processamento destes no SNC. A disfunção desse sistema está associada a um maior risco de cronificação da dor7. Clinicamente, a SC se caracteriza pela presença de hiper-algesia e alodínia, além de expansão da área de dor tornando-a mais difusa e com envolvimento de tecidos sem alterações visíveis1,8.
2. Sensibilização Central e Disfunção Temporomandibular
A Disfunção Temporomandibular (DTM) está frequentemente associada à presença de outras condições dolorosas ou não-dolorosas, que são as chamadas comorbidades. As condições mais associadas à DTM são a fibromialgia9, síndrome do intestino irritável10, síndrome da fadiga crônica11, cefaleias primárias (especialmente a migrânea), cervicalgia e lombalgia12,13. Além das comorbidades dolorosas, alterações psicossociais como depressão e ansiedade, também são frequentemente encontradas em indivíduos com DTM e que apresentam outras condições dolorosas14,15.
O número de comorbidades está relacionado com maior duração dos sinais e sintomas da DTM e também com sua intensidade11. Essa relação ocorre principalmente pela participação de mecanismos envolvidos com a SC1,5. Portanto, a avaliação de pacientes apresentando DTM não deve levar em conta apenas os mecanismos periféricos envolvidos com a disfunção, mas também considerar a presença de sinais e sintomas compatíveis com a SC16.
3. Avaliação dos Sinais e Sintomas Relacionados à Sensibilização Central
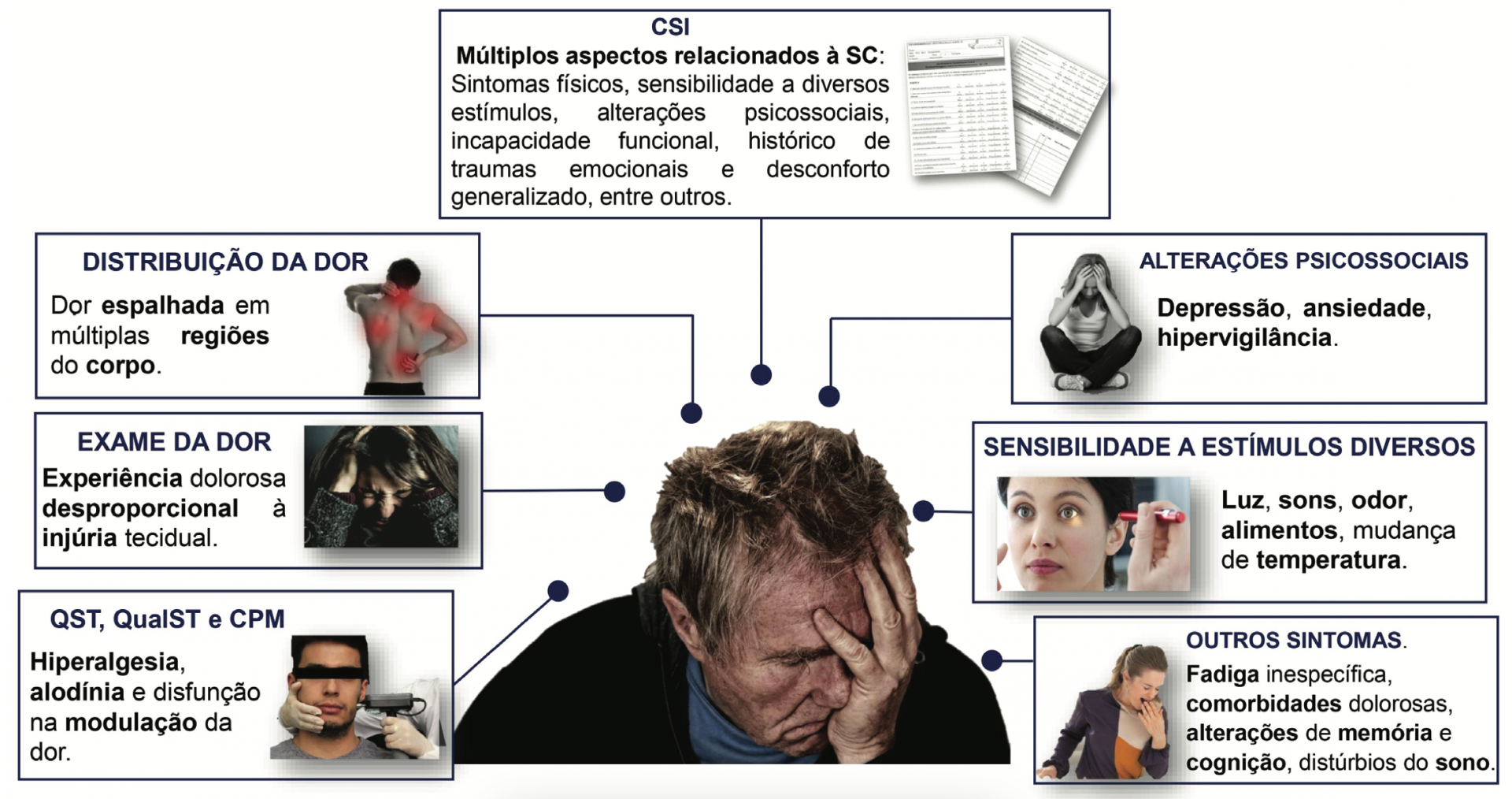
A SC não pode ser medida de maneira direta1,17. Contudo, algumas ferramentas permitem avaliar sinais e sintomas que podem estar relacionados a essa condição. Os testes quantitativos sensoriais (Quantitative Sensory Testing – QST), os qualitativos somatossensoriais (Qualitative Somatosensory Testing - QualST), e ainda o teste de Modulação Condicionada da Dor (Conditioned Pain Modulation – CPM), podem inferir a existência de SC ao identificarem sinais e sintomas compatíveis com SC, como hiperalgesia, alodínia e disfunção na modulação da dor1,5,18–20. Esses métodos permitem a avaliação de alterações somatossensoriais relacionadas à SC por meio da aplicação de diferentes estímulos e a observação da intensidade de resposta dos indivíduos5,18–20. Na prática clínica, o QualST é mais simples e fácil de ser realizado se comparado aos demais. Sua confiabilidade parece ser suficiente para a avaliação inicial da função somatossensorial19. De maneira geral, o protocolo para esse conjunto de testes recomenda a utilização de uma haste flexível para promover um estímulo tátil, uma espátula odontológica resfriada pode promover um estímulo térmico e uma sonda exploratória para promover um estímulo nocivo19. A resposta do paciente frente aos estímulos pode indicar a presença de alodínia e hiperalgesia19.
Outra ferramenta de fácil e rápida aplicação para avaliação de sintomas relacionados à SC é o Inventário de Sensibilização Central (Central Sensitization Inventory – CSI)8,21–24. O CSI é composto por 25 questões sobre sintomas somáticos e emocionais, com escore variando de 0 a 100 pontos21. Tem sido sugerido que escores mais altos indicam mais sintomas associados à SC8,21–24. De acordo com a pontuação do inventário, foram estabelecidos cinco níveis de severidade dos sintomas: subclínico – 0-29 pontos; leve – 30-39 pontos; moderado – 40-49 pontos; severo – 50-59 e extremo – 60-10024. Idealmente, o CSI deve ser utilizado em conjunto com o exame completo da dor para identificar a presença de SC25.
Muitas vezes, na presença de SC, não é possível identificar uma alteração tecidual capaz de explicar a dor relatada, fato frequentemente observado nos pacientes com DTM5,25. Assim, um exame clínico cuidadoso se torna ainda mais importante. A Figura 1 apresenta alguns métodos de avaliação, além de sinais e sintomas que podemos observar durante o exame clínico de pacientes com características compatíveis com SC1,5,25,26,8,18–24.
4. Manejo terapêutico do paciente com sensibilização central
A presença de SC pode ter um efeito negativo sobre o manejo terapêutico do paciente, especialmente quando somente abordagens periféricas são utilizadas5,25. Assim, na elaboração do plano de tratamento, é altamente relevante considerarmos a presença de alterações centrais25. Idealmente, quando o paciente apresenta uma fonte de dor periférica e características condizentes com a SC, a abordagem terapêutica deve envolver tanto o controle dos mecanismos periféricos quanto centrais. Considerando a DTM, o tratamento periférico pode incluir aconselhamento e instrução de procedimentos de autocuidado (como massagens e compressas), técnicas fisioterápicas, utilização de dispositivos intraorais quando indicados, medicamentos como relaxantes musculares e antinflamatórios5, agulhamento seco, bloqueios anestésicos e outras abordagens que visam o controle da disfunção e da dor articular e/ou muscular.
O manejo terapêutico visando controle da SC pode incluir desde farmacoterapia como também abordagens voltadas aos aspectos psicossociais como terapia cognitivo comportamental (TCC), educação em neurociência, controle de hábitos, higiene do sono, entre outros. As opções farmacológicas incluem o uso de medicamentos de ação central como antidepressivos tricíclicos e duais e anticonvulsivantes5,27. Contudo, deve-se ter cautela com a prescrição desses fármacos, pois sua utilização ainda é alvo de discussões na literatura. Pacientes com características de SC frequentemente não entendem sua própria dor e o motivo de não responderem a tratamentos locais25. A educação em neurociência auxilia esses indivíduos a entenderem melhor os mecanismos envolvidos com a dor. Colabora também na compreensão de que a dor muitas vezes é desproporcional a uma lesão periférica presente ou que, em alguns casos, ela não está relacionada diretamente com uma lesão tecidual identificável25,27. A educação em neurociência tende a reduzir a experiência dolorosa e a incapacidade a ela relacionada27. Controlar os fatores que contribuem para a dor também é fundamental durante o tratamento. A prática de exercícios físicos favorece os processos de modulação da dor e também os aspectos psicossociais28. A TCC auxilia no manejo da depressão, ansiedade e estresse, além de possivelmente agir nas áreas cerebrais responsáveis pelo processamento da dor29.
Resumindo, o manejo terapêutico do paciente com características de SC deve considerar aspectos periféricos e centrais, procurando identificar os fatores contribuintes. Preferencialmente, deve ser multiprofissional e direcionado às características específicas de cada indivíduo.
- 1. Woolf CJ. Central Sensitization: Implications for the diagnosis and treatment of pain. Pain. 2011;152 (3 Supplemental):1–31.
- 2. Arendt-Nielsen L. Central Sensitization in Humans: Assessment and Pharmacology. In: Handbook of experimental pharmacology. 2015. p. 79–102.
- 3. Chichorro JG, Porreca F, Sessle B. Mechanisms of craniofacial pain. Cephalalgia. 2017 Jun;37(7):613–26.
- 4. Sessle BJ. Peripheral and central mechanisms of orofacial pain and their clinical correlates. Minerva Anestesiol. 2005 Apr; 71(4): 117–36.
- 5. Harper DE, Schrepf A, Clauw DJ. Pain Mechanisms and Centralized Pain in Temporomandibular Disorders. J Dent Res. 2016 Sep 20; 95 (10): 1102–8.
- 6. Lewis GN, Rice DA, McNair PJ. Conditioned pain modulation in populations with chronic pain: A systematic review and meta-analysis. J Pain. 2012; 13 (10): 936–44.
- 7. Costa YM, Conti PCR, de Faria FAC, Bonjardim LR. Temporomandibular disorders and painful comorbidities: clinical association and underlying mechanisms. Oral Surg Oral Med Oral Pathol Oral Radiol. 2017 Mar; 123 (3): 288–97.
- 8. Caumo W, Antunes L, Lorenzzi Elkfury J, Herbstrith E, Busanello Sipmann R, Souza A, et al. The Central Sensitization Inventory validated and adapted for a Brazilian population: psychometric properties and its relationship with brain-derived neurotrophic factor. J Pain Res. 2017 Sep; 10: 2109–22.
- 9. Eriksson P, Lindman R, Stal P, Bengtsson A. Symptoms and signs of mandibular dysfunction in primary fibromyalgia syndrome (PSF) patients. Swed Dent J. 1988; 12 (4): 141–9.
- 10. Kindler LL, Bennett RM, Jones KD. Central Sensitivity Syndromes: Mounting Pathophysiologic Evidence to Link Fibromyalgia with other Common Chronic Pain Disorders. Pain Manag Nurs. 2011;12(1):15–24.
- 11. Dahan H, Shir Y, Velly A, Allison P. Specific and number of comorbidities are associated with increased levels of temporomandibular pain intensity and duration. J Headache Pain. 2015; 16(47).
- 12. Tchivileva IE, Ohrbach R, Fillingim RB, Greenspan JD, Maixner W, Slade GD. Temporal change in headache and its contribution to the risk of developing first-onset temporomandibular disorder in the Orofacial Pain: Prospective Evaluation and Risk Assessment ( OPPERA ) study. Pain. 2017;158:120–9.
- 13. Gonçalves D a G, Bigal ME, Jales LCF, Camparis CM, Speciali JG. Headache and symptoms of temporomandibular disorder: an epidemiological study. Headache. 2010 Feb; 50(2): 231–41.
- 14. Campbell CM, Ph D, Buenaver LF, Ph D, Finan P, Ph D, et al. Sleep, pain catastrophizing and central sensitization in knee osteoarthritis patients with and without insomnia. 2016; 67(10): 1387–96.
- 15. Peres MFP, Mercante JPP, Tobo PR, Kamei H, Bigal ME. Anxiety and depression symptoms and migraine: a symptom-based approach research. J Headache Pain. 2017 Dec; 18(1): 37.
- 16. Slade GD, Ohrbach R, Greenspan JD, Fillingim RB, Bair E, Sanders AE, et al. Painful Temporomandibular Disorder: Decade of Discovery from OPPERA Studies. J Dent Res. 2016 Sep; 95 (10): 1084–92.
- 17. Arendt-Nielsen L, Morlion B, Perrot S, Dahan A, Dickenson A, Kress HG, et al. Assessment and manifestation of central sensitisation across different chronic pain conditions. Eur J Pain (United Kingdom). 2018; 22(2): 216–41.
- 18. Kothari SF, Baad-Hansen L, Oono Y, Svensson P. Somatosensory assessment and conditioned pain modulation in temporomandibular disorders pain patients. Pain. 2015; 156(12): 2545–55.
- 19. Baad-Hansen L, Pigg M, Ivanovic SE, Faris H, List T, Drangsholt
M, et al. Chairside Intraoral Qualitative Somatosensory Testing: Reliability and Comparison Between Patients with Atypical Odontalgia and Healthy Controls. J Orofac Pain. 2013; 27(2): 165–70. - 20. Rolke R, Magerl W, Campbell KA, Schalber C, Caspari S, Birklein F, et al. Quantitative sensory testing: A comprehensive protocol for clinical trials. Eur J Pain. 2006; 10(1): 77–88.
- 21. Mayer TG, Neblett R, Cohen H, Howard KJ, Choi YH, Williams MJ, et al. The development and psychometric validation of the central sensitization inventory. Pain Pract. 2012; 12(4): 276–85.
- 22. Neblett R, Cohen H, Choi Y, Hartzell MM, Williams M, Mayer TG, et al. The Central Sensitization Inventory (CSI): establishing clinically significant values for identifying central sensitivity syndromes in an outpatient chronic pain sample. J Pain. 2013; 14(5): 438–45.
- 23. Neblett R, Hartzell MM, Cohen H, Mayer TG, Williams M, Choi Y, et al. Ability of the Central Sensitization Inventory to Identify Central Sensitivity Syndromes in an Outpatient Chronic Pain Sample. Clin J Pain. 2015; 31(4): 323–32.
- 24. Neblett R, Hartzell MM, Mayer TG, Cohen H, Gatchel RJ. Establishing Clinically Relevant Severity Levels for the Central Sensitization Inventory. Pain Pract. 2017; 17(2): 166–75.
- 25. Nijs J, Goubert D, Ickmans K. Recognition and treatment of central sensitization in chronic pain patients: Not limited to specialized care. J Orthop Sports Phys Ther. 2016;46(12):1024–8.
- 26. Williams DA. Phenotypic features of central sensitization. J Appl Biobehav Res. 2018; 23(2).
- 27. Nijs J, Leysen L, Vanlauwe J, Logghe T, Ickmans K, Polli A, et al. Treatment of central sensitization in patients with chronic pain: time for change? Expert Opin Pharmacother [Internet]. 2019;20(16):1961–70. Available from: https://doi.org/10.1080/14656566.2019.1647166
- 28. Bonakdar RA. Integrative Pain Management. Med Clin North Am [Internet]. 2017;101(5):987–1004. Available from: http://dx.doi.org/10.1016/j.mcna.2017.04.012
- 29. Eller-Smith OC, Nicol AL, Christianson JA. Potential Mechanis- ms Underlying Centralized Pain and Emerging Therapeutic Interventions. Front Cell Neurosci. 2018;12(February):1–18.